SHP2含Src同源性2结构域的蛋白酪氨酸磷酸酶2
1. 靶点介绍
SHP2 是近年新兴的一个明星抗肿瘤药物靶点,是由 PTPN11 基因编码的细胞质非受体蛋白酪氨酸磷酸酶(protein tyrosinephosphatase,PTP),包含 2 个 SH2 结构域和 1 个 PTP 催化结构域,可以催化磷酸化的底物(如受体、激酶等)去磷酸化,从而调控下游信号。
SHP2 是 PTP 家族中第一个被证实的原癌蛋白,是生长因子信号通路和免疫检查点信号通路的重要调节因子,参与 Ras/Raf/MEK/ERK、JAK/STAT、PI3K/AKT/mTOR 和 PD-1/PD-L1 等多种信号通路,与细胞增殖、迁移、分化和凋亡等密切相关,可以促进肿瘤的发生和发展。SHP2 的活化突变或表达上调与肺腺癌、结肠癌、乳腺癌和黑色素瘤等多种实体瘤和白血病的发生有密切关系。此外,SHP2 还介导了 MEK 等激酶被抑制之后的代偿性激活途径,从而促进肿瘤耐药。SHP2 同时也是潜在的免疫调节靶点,在肿瘤微环境中发挥着至关重要的调控作用。抑制 SHP2 可潜在抑制肿瘤细胞生长,克服肿瘤细胞靶向耐药、激活免疫系统,从而发挥抗肿瘤作用,SHP2 已成为当下抗肿瘤新药研发的热门靶点之一。
2. 临床研究申报概况
迄今为止,全球还没有 SHP2 抑制剂获批上市。目前进入临床研发阶段的 SHP2 抑制剂共 15 种,均处于Ⅰ~Ⅱ期的早期临床研究阶段。国外在研的 SHP2 抑制剂包括诺华制药研发的 TNO155 和 SHP009、Revolution Medicines/赛诺菲公司联合研发的 RMC-4630、Erasca 公司的 ERAS-601、Relay Therapeutics 公司的 RLY-1971 和辉瑞公司的 PF-07284892等;国内企业研发的 SHP2 抑制剂包括加科思药业的 JAB-3068 和 JAB-3312、联拓生物的 BBP-398、奕拓医药的 ET0038、圣和药业的 SH3809、上海歌斐木生物的 BR790 及诺诚健华的 ICP-189 等
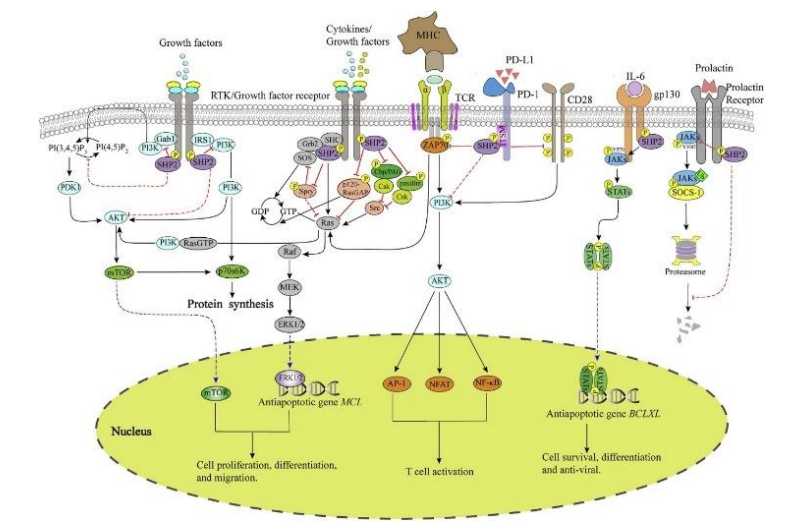
图片来源:Yihui Song,MinZhao,Huiqing Zhang,et al.Double-edged roles of protein tyrosinephosphatase SHP2 in cancer and its inhibitors in clinical trials[J]. Pharmacology & Therapeutics, 2022,230: 107966.doi:10.1016/j.pharmthera.2021.107966.
SHP2 抑制剂中目前研发较快的药物有 TNO-155、RMC-4630 及国内企业加科思药业的 JAB-3068 和 JAB-3312,这些药物均已进入Ⅱ期临床阶段。JAB-3068 和 JAB-3312 分别于 2019 年 2 月和 2020 年 9 月通过了 FDA 治疗食管癌的孤儿药认定。
目前国内 10 余项临床研究正在进行中,由于 SHP2 抑制剂作用机制特殊、靶点新颖,多项包括 SHP2 抑制剂单药的安全性耐受性评价和 SHP2 抑制剂联合用药临床研究正在开展。
多个 SHP2 抑制剂单药治疗实体瘤的Ⅰ期临床研究正在开展,其中部分研究公布了初步。临床研究结果。在 ASCO 2021 年会上,诺华披露了 TNO155 单药治疗实体瘤的Ⅰ期临床试验初步结果。截至 2020 年 10 月,试验共纳入 118 名受试者,其中 SD 达 20%,中位 SD持续时间为 4.9 个月。92%的受试者(109/118)退出了试验,其中,80%(94/118)的患者出现 PD,5%(6/118)由于不良事件退出了试验。TNO155 单药治疗耐受性良好,但疗效欠佳。2020 年美国癌症研究协会(American Association for Cancer Research,AACR)大会报道了由 Revolution Medicine/Sanofi 联合研发 RMC-4630 的Ⅰ期临床研究数据,针对 KRAS突变肺癌患者,RMC-4630 治疗的疾病控制率(DCR)为 67%,其中对 KRAS G12C 突变肺癌患者,DCR 可达 75%,且有 1 例患者疗效达 PR。RMC-4630 最常见的 3 级及以上不良事件包括血小板减少(14.3%)、贫血(12.2%)、高血压(8.2%)等,研究还发现间断给药较每日给药提升了药物的耐受性,不良事件显著降低。加科思药业招股说明书公布了JAB-3068 的Ⅰ期临床数据,在可评估的 23 名患者中,SD 达 39.1%(9/23)。其中有 11 名患者曾接受过 PD-1/PD-L1 治疗,6 名患者使用 JAB-3068 后达到 SD。3 级及以上 TRAE 达34.4%,主要包括血小板减少、AST、ALT 水平升高等,8 名患者因 TRAE 终止治疗。JAB-3312 是加科思药业的另一个 SHP2 抑制剂,在美国开展的一项Ⅰ期研究显示,JAB-3312 单药治疗实体瘤的 DCR 达 50%(6/12)。3 级及以上 TRAE 发生率达 26.7%,主要包括贫血(13.3%)和血小板减少(13.3%)。其他在研的多个研究还未发表 I 期临床研究结果。
从上面研究数据看来,SHP2 抑制剂单药治疗实体瘤疗效并不非常理想,或许联合用药才是未来突破的关键研发策略。SHP2 参与多条关键信号通路,还可作为小分子免疫调节剂。根据其联合靶点的不同,国内外药企开展了 SHP2 抑制剂联合用药临床研究又可以细分为 SHP2 抑制剂联合信号通路抑制剂、SHP2 抑制剂联合免疫治疗等多个联合探索研究。研究举例:评价 JAB-3312 与帕博利珠单抗或 MEK 抑制剂 Binimetinib 联合用药在成人晚期实体瘤受试者中的安全性、耐受性、药代动力学和初步抗肿瘤活性的多中心、开放、Ⅰ/Ⅱa 期临床研究;探索 TNO155 与 LEE011(CDK4/6 抑制剂)或 PDR001(PD-1 抑制剂斯巴达珠单抗)在特定实体瘤患者中的安全性、耐受性和初步有效性的Ⅰb 期、开放、多中心研究;评价 JAB-3068 联合特瑞普利单抗(JS001)用于晚期实体瘤患者的安全性、耐受性、药代动力学和抗肿瘤活性的多中心、开放、剂量递增及扩展的Ⅰb/Ⅱa 期临床研究等 。
在 WCLC2022 年会上,Revolution Medicines/Sanofi 公布了 RMC-4630 联合 Sotorasib(索托拉西布,KRAS G12C 抑制剂)治疗 KRAS G12C 突变 NSCLC、CRC 或其他实体瘤的Ⅰb 期临床研究(CodeBreak101)的数据。截至 2022 年 1 月 17 日,研究入组了 21 例既往接受过中位二线治疗的患者,包括 11 例 NSCLC、6 例 CRC 和 4 例其他实体瘤患者。在入组的 11 例 NSCLC 患者中,3 例 (27%)达到确认的 PR,7 例(64%)达到疾病控制。在接受最高剂量(140mg,200mg)RMC-4630 联合 Sotorasib 的 4 例 KRAS G12C 抑制剂初治 NSCLC 患者中,3 例(75%)达到确认的 PR,4 例全部(100%)达到疾病控制。在 6 例 CRC 患者中,5 例达到疾病控制。安全性方面,6 例(29%)患者发生 3 级 TRAE,未观察到≥4 级的 TRAEs。联合治疗疗效明显优于 SHP2 单药治疗,毒性并未大幅增加,值得进一步探索。
3. 未来发展方向
由于其 PTP 催化位点的高度保守和正电性,SHP2 曾被认为是“不可成药”靶点。但随着近年来作用于蛋白磷酸酶催化域以外潜在位点的小分子变构抑制剂、蛋白降解靶向联合体(proteolysis-targeting chimeras,PROTACs)等技术的发展,SHP2 靶向成药研发逐渐获得突破性进展,新型的 SHP2 抑制剂临床应用结果值得期待。
因 SHP2 为多个信号通路的汇聚节点,SHP2 抑制剂与多个信号通路成员的抑制剂或抗体的联合用药(联合 RTKs、Raf、MEK、ERK 和 PD-1 抗体等)可潜在增强抗肿瘤应答、增加抗肿瘤免疫,表现出协同抗肿瘤作用。
SHP2 抑制剂联合其他激酶抑制剂能降低肿瘤细胞获得性耐药的风险、有克服耐药的潜力。在 Ras/Raf/MEK/ERK 通路中,SHP2 是关键上游因子。在受体酪氨酸激酶(RTK)获得性耐药/KRAS 突变耐药中,SHP2 促进了信号通路的代偿性激活,而抑制 SHP2 可以消除信号通路的重新激活,有助于克服靶向耐药。目前国内外制药企业均在探索 SHP2 抑制剂与 KRAS G12C 抑制剂的联合用药效果,早期临床研究观察到了有前景的临床疗效。
SHP2 小分子抑制剂可作为一种小分子肿瘤免疫治疗药物,调节免疫微环境。在 PD-1/PD-L1 信号通路中,SHP2 是关键的下游效应因子,抑制 SHP2 可以激活 T 细胞,增强免疫应答。此外,SHP2 抑制还能改变免疫微环境中肿瘤相关巨噬细胞的极化状态,这为SHP2 抑制剂联合免疫治疗提供了坚实的理论基础。未来还可探究 SHP2 对肿瘤微环境中其他免疫细胞的影响, 进一步了解 SHP2 在抗肿瘤免疫中的作用。目前诺华、加科思药业等均在探索 SHP2 抑制剂与 PD-1/PD-L1 抗体药物联合治疗的疗效,联合治疗的疗效值得期待。
SHP2 的作用机制也较为复杂,在 PI3K/AKT 通路中,SHP2 在不同细胞中调控作用不同,有研究发现 SHP2 抑制可导致重要的促癌因子 STAT3 的反馈激活,SHP2 抑制剂能否与 JAK/STAT、PI3K/AKT/mTOR 通路成员的抑制剂联合,需要进一步的机制探索
4. 简评
随着药物开发策略的不断开拓发展,靶向 SHP2 为抗肿瘤治疗提供了广阔的应用前景。初步的临床研究结果中提示 SHP2 抑制剂展现了良好的耐受性。靶向 SHP2 的联合治疗方案可能会成为未来探索的主要方向,其中 SHP2 抑制剂联合 KRAS 抑制剂的疗效尤其值得期待。预计未来几年靶向 SHP2 抗肿瘤药物的开发会成为热点之一。

 2023-07-04
2023-07-04 
 MCE
MCE
