IL-1α白介素-1α
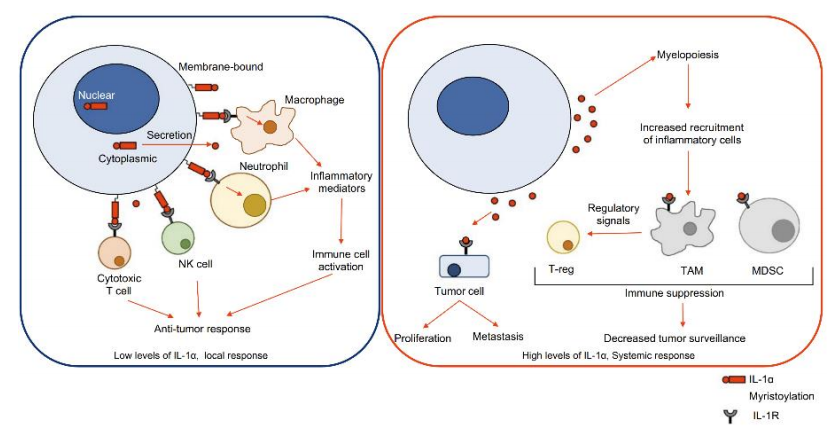
IL-1α 是属于由 IL1A 基因编码的 IL-1 家族的细胞因子。IL-1α 在核内首先经转录翻译为由 271 个氨基酸组成、分子量为 31kD 的前体蛋白(pro-IL-1α),pro-IL-1α 可以被切割成更小的 17kD 成熟形式并结合细胞表面受体 IL-1R1,和同家族的 IL-1β 触发相同的 IL-1R1 下游信号。pro-IL-1α 蛋白可以被切割为 17kD 的 C 端成熟形式和 16kD 的 N 末端前体肽段(N-terminal IL-1α propiece,IL-1α-NTP)。与 IL-1β 不同,pro-IL-1α 和成熟的 IL-1α对 IL-1R1 有相同的生物活性,且 IL-1α 既可作为分泌型细胞因子,又可作为 IL-1 家族中仅有的膜结合型细胞因子。另外,IL-1β 与炎症小体和 caspase-1 存在相互作用,而 IL-1α并不参与相应过程。除分泌到胞外,pro-IL-1α 和 IL-1α-NTP 可以反向入核,直接与组蛋白乙酰转移酶 p300、PCAF 和 GCN5 相互作用,并刺激基因转录,包括编码促炎因子、趋化因子的基因与 IL-1R1 相关蛋白
IL-1β 在体内平衡的细胞中不存在,并且仅在造血来源的细胞中激活后表达,但 IL-1α 存在于多种健康细胞中,并且在造血细胞和非造血细胞中表达,以响应外界刺激。IL-1α 在稳态健康组织的许多细胞类型中组成性表达,其表达可以响应生长因子、促炎或应激相关刺激而增加。
在生理情况下,IL-1α 响应外界扰动以启动和维持炎症过程。IL-1α 被称为“警报素”(alarmin),在损伤或感染导致的细胞死亡后泄漏到周围环境、以 IL-1R1 依赖性方式激活炎症。IL-1R1 下游信号通路通过促进趋化因子表达将炎性造血细胞募集到损伤或应激部位。这些造血细胞对含有 IL-1α 的环境做出反应,其中 pro-IL-1α 可以从受损细胞中释放出来,或者作为膜结合 IL-1α 暴露在经历氧化或代谢应激的细胞表面,进而在 IL-1R1 下游激活它们自己产生 IL-1α 和 IL-1β。因此,最初的 IL-1α–IL-1R1 信号转导可以启动一个持续和自我延续的炎症循环,导致广泛的组织损伤,直到 IL-1R1 信号传导耗尽或被抑制。推荐阅读:白细胞介素
IL-1α 与癌症、自身免疫性疾病、感染性疾病和其他炎性疾病有关。癌细胞、肿瘤浸润免疫细胞和基质细胞可表达 IL-1α 和 IL-1R1。IL-1α 作为炎症的顶端激活物,参与癌症发生的早期环节,维持早期癌症的低度慢性炎症。肿瘤组织及其微环境中的 IL-1R1 信号可以不同方式影响肿瘤进展。来自肿瘤微环境的 IL-1α 可以作用于癌症干细胞,上调干性相关基因表达、促进增殖和上皮-间充质转化。IL-1R1 信号还促进趋化因子和黏附分子的表达,募集免疫细胞到肿瘤组织中,以及上调基质金属蛋白酶表达以促进肿瘤侵袭和转移。IL-1R1 信号驱动骨髓细胞生成和髓源性抑制细胞(myeloid-derived suppressor cell,MDSC)的分化过程,促进促生存因子的产生并抑制抗肿瘤免疫反应。另一方面,在低 IL-1α 水平时,IL-1R1 信号也可以增强抗肿瘤免疫,有助于募集抗原呈递细胞到淋巴结、诱导肿瘤特异性 CD4+和 CD8+T 细胞的免疫记忆的激活和形成。因此,和大多数细胞因子类似,1R1 信号具有多效性,这可能取决于 IL-1α 水平和肿瘤及其微环境的特征。在头颈部鳞状细胞癌和卵巢癌患者中,IL-1α 已被评估为风险因素。
作为肿瘤的标志之一,炎症被证明与肿瘤的发生发展具有密切关系,而 IL-1α 作为炎症的顶端激活物参与促癌炎症的维持,以及 IL-1α 与肿瘤微环境中其他组分、与促癌信号通路的相互作用显示了将 IL-1α 作为抗肿瘤药物靶点的开发展望。然而由于 Bermekimab在晚期结肠癌方面未取得显著优势,目前 IL-1α 的开发转向了自身免疫性疾病和感染性疾病领域,但这并不能掩盖 IL-1α 在肿瘤领域的潜力。与其他细胞因子靶点的药物相同,这类药物均具有类似的药动学和药代学问题:①细胞因子本身的多效生物学导致的药物多效性问题。②非定向药物分布导致的不充足的靶向性。第一点特别被上面提到的 IL-1α/IL-1R1 的环境依赖性的生物学所反映。因此,IL-1α 未来的破局方向可以考虑进一步阐明 IL-1α 的生物学细节、与其他疗法联用、针对 IL-1α 受体(IL-1R1、IL-1RAP)等开发阻断抗体、开发多特异性的细胞因子融合蛋白及多特异性抗体等,重新从动物实验水平进行探索再进一步临床验证。

 2023-07-10
2023-07-10 
 MCE
MCE
