CRISPR/Cas9基因编辑
CRISPR/Cas9 作为一种高效且广泛应用的基因编辑方法,迅速成为研究的热点。近年来,随着人们对 CRISPR/Cas9 技术研究的深入,打开了恶性肿瘤和遗传病治疗的新视角。小分子何助力 CRISPR/Cas9,如何做到“如虎添翼”
基因编辑,“何方神圣”
基因编辑是一种对靶基因或转录产物进行敲除、插入和定点突变等精确修饰的基因工程技术,主要通过人工核酸酶实现对基因组的特定基因序列的敲除、插入或精确修饰。目前,主要有三大基因编辑技术,包括:锌指核酸酶 (Zinc finger nucleases; ZFNs) 技术,转录激活因子样效应物核酸酶 (transcription activator-like (TAL) effector nucleases; TALENs) 技术和 CRISPR/Cas9 技术。
ZFNs 是最较早用于基因组编辑的人工合成的限制性内切酶,该酶是异源二聚体,包含 DNA 结合锌指蛋白 (ZFP) 结构域和非特异性 FokI 核酸酶结构域。DNA 切割域的 FokI 核酸酶必须二聚化以切割 DNA。该技术已被用于修饰各种生物体内的内源性基因。
与 ZFNs 的模块化结构一样,TALENs 的羧基末端也含有 FokI 核酸酶结构域,它借助 TALEs(来源于植物致病性黄单胞菌属细菌) 来识别特异性 DNA 碱基对。相较于 ZFNs 技术,其优势在于可以定点识别靶基因,从而使得基因编辑更加准确高效,其脱靶效应以及细胞毒性也得到了显著改善。
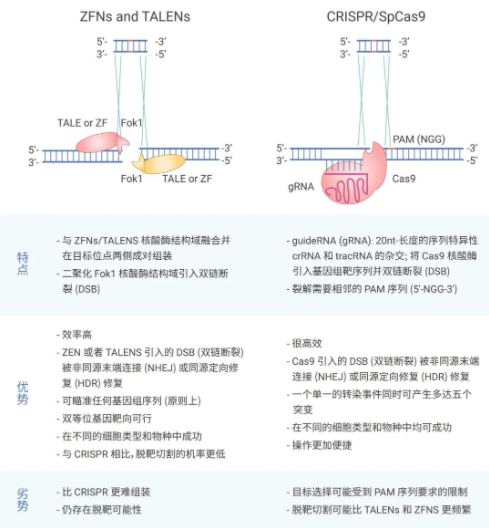
图 1. 不同基因编辑手段的对比
2020 年,两位女性科学家 Emmanuelle Charpentier 和 Jennifer A. Doudna 因发现 CRISPR/Cas9 基因剪刀,而获得 2020 年诺贝尔化学奖。
CRISPR/Cas 系统由一小段 RNA 和一种高效的 DNA 切割酶 (Cas 核酸酶) 组成的系统,该技术不像 TALENs 技术和 ZFNs 技术是依赖于蛋白与靶基因之间的识别,而是由 sgRNA 和靶基因之间形成复合物,从而完成特定基因序列的编辑。
CRISPR/Cas9 技术切割效率相对较高且操作简单,并且可以同时进行多位点的编辑。总之,三种不同的基因编辑技术都有其各自的特点。今天小 M 的“重头戏”,CRISPR/Cas9。
CRISPR/Cas9 的调控机制
在细菌及古细菌中,CRISPR 系统共分成 3 类,其中 I 类和 Ⅲ 类需要多种 CRISPR 相关蛋白 (Cas 蛋白) 共同发挥作用。而来自的 Ⅱ 型系统只需要一种 Cas 蛋白 (Cas9) 即可发挥核酸内切酶活性。因此,CRISPR/Cas9 系统应用最为广泛。CRISPR/Cas9 系统已经成功应用于植物、细菌、酵母、鱼类及哺乳动物细胞。
■ 第一步:捕获外源 DNA
Cas9 蛋白包含两个核酸酶结构域:切割非互补 DNA 链的 RuvC 结构域和切割互补 DNA 链的 HNH 结构域 (如图 2a)。
噬菌体等外源 DNA 入侵时,CAS 蛋白复合物通常识别 3' 端含 NGG 的前间隔序列邻近基序 (PAM) 区域。然后,侵入的噬菌体或质粒释放的短 DNA 片段(称为 Protospacer),插入宿主 CRISPR 位点中 (由重复序列隔开)。
■ 第二步:crRNA 合成
CRISPR 序列转录,形成前体 CRISPR RNA (pre-crRNA)。Cas9 及 RNase III 在 tracrRNA 与 pre-crRNA 上的重复序列配对形成双链 RNA 的条件下,对 pre-crRNA 进行剪切,形成成熟的 tracrRNA-crRNA 双链 RNA (即 sgRNA)。Cas9 核酸酶和 sgRNA 形成 Cas9 核糖核蛋白 (RNP)。
■ 第三步:靶向干扰
当外源 DNA 再次进入细胞时,Cas9 蛋白携带sgRNA,去识别外源 DNA 的 Protospacer (前间隔序列),并与之结合,通过 Cas9 解旋酶和核酸酶对靶基因进行剪切。造成靶基因 DNA 的双链断裂 (DSB),从而达到干扰靶基因表达的目的,在修复断裂同时引入基因敲除或敲入。
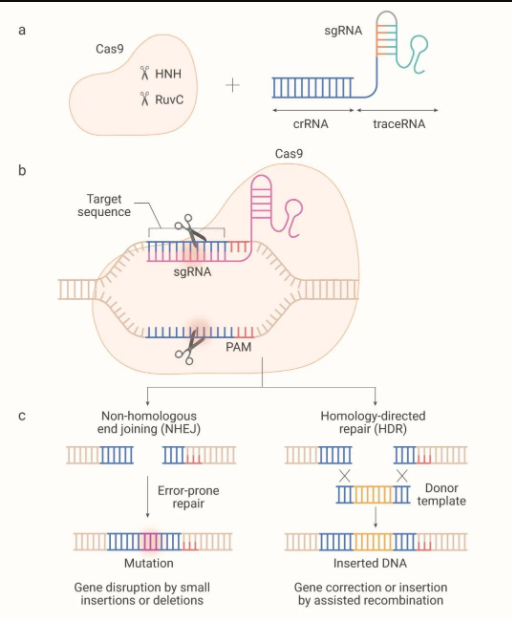
图 2. 通过非同源末端连接 (NHEJ) 或同源定向修复 (HDR) 内源性修复双链 DNA 断裂
综上,CRISPR 技术主要是利用位点特异 Cas 核酸酶在基因组靶位点处引入 DNA DSB,再经细胞自身的非同源末端连接 (NHEJ) 或同源重组修复(HDR)对 DSB 进行修复,最终实现目标基因敲除和碱基编辑等基因组遗传修饰。
CRISPR/Cas9 的小分子调控策略
CRISPR 技术在疾病治疗、基因功能调控、药物研发等多个方面具有广阔的应用前景,但也存在脱靶、基因毒性等副作用问题。由于 Cas9 蛋白和 sgRNA 在其自身活性、识别位点及结合能力等方面的不同特性,因此在应用中可以通过对 Cas9 蛋白酶以及与靶 DNA的结合进行有效的调控。目前,如:遗传调节、小分子激活剂、小分子抑制剂、生物响应性输送载体以及 CRISPR/Cas9 系统的光/热/超声/磁激活等方法已被研究开发。
■ 小分子激活剂控制 Cas9 活性的策略
可通过添加小分子来控制 Cas9 的构象变化,来实现对 Cas9 蛋白活性的时空控制。
案例 1:当内含肽插入 Cas9 蛋白的不同位点,Cas9 核酸酶失活;添加 4-HT (4-hydroxytamoxifen),通过构象变化和自切割反应去除内含肽,可重新激活 Cas9 蛋白(图 3a)。根据内含肽的插入位点,Cas9 的激活效率 3 倍到 10 倍不等,与野生型 Cas9 相比,这种调控策略可增加开/脱靶效应比率。
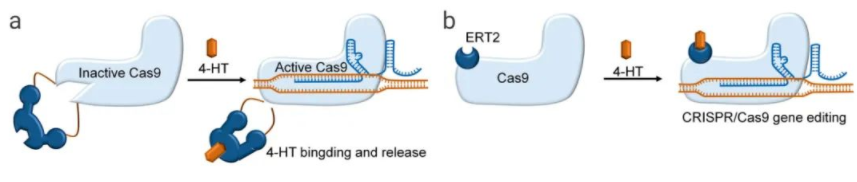
图 3. 小分子激活剂控制 Cas9 活性的策略
a:通过 4-HT 结合,恢复失活的 Cas9 活性;b:Cas9 和雌激素受体 (ERT2) 的融合被分离在细胞质中,通过添加 4-HT 使得融合物进入细胞核,形成 Cas9/sgRNA 复合物
案例 2:基于化学诱导的 Cas9 蛋白分裂片段的二聚化。Zetsche 等人设计了不同的分裂位点 (Arg535 和 Glu573) 生成分裂 Cas9 (split-Cas9) 蛋白,同时产生 C 端和 N 端Cas9 片段 (可分别与 FK506 结合蛋白 (FKBP) 和 FKBP 雷帕霉素结合结构域 (FRB) 结合)。这种方法通过雷帕霉素诱导的异源二聚作用实现了 split-Cas9 的条件重构和激活。
图 4. 小分子激活剂控制 Cas9 活性的策略
■ 小分子抑制剂控制 Cas9 活性的策略
由于 Cas9 活性的升高和持续可能会导致脱靶效应、染色体易位和遗传毒性,因此在目标编辑后,Cas9 核酸酶活性必须迅速限制在一个狭窄的时间范围内。
如下图 5 所示,DHFR (ER50)是一个不稳定的结构域,可快速靶向 Cas9 蛋白进行蛋白酶体介导的 Cas9 降解,但添加小分子抑制剂甲氧苄氨嘧啶 (TMP) 或 4-OHT 后可以使其稳定。用 Cas9-DHFR 或 Cas9-ER50 系统编辑 VEGFA 基因时,用不同剂量的TMP 或 4OHT 剂量依赖性控制靶向 VEGFA 基因的复合物 Cas9-DHFR (ERR50) 的靶向和非靶向活性。
图 5. 小分子抑制剂控制 Cas9 活性的策略
总结
CRISPR-Cas9 系统已成为一种在任何细胞基因组的精确位置进行修改的有效工具。Cas9 介导的 DNA 切割后发生的主要细胞修复途径是错误的非同源末端连接 (NHEJ) 途径。同源定向重组(HDR)的效率远远低于 NHEJ。因此,降低 NHEJ 的频率,同时增加 Cas9 介导的 DNA 切割后的 HDR 效率,从而提高基因组编辑的整体效率和精准度成为科学家关注的焦点。与此同时,通过研究人员的不断努力,生物活性小分子提供了一种简单而有效的调控策略,可进一步拓宽精确基因组编辑的应用范围。
相关产品
RS-1
一种 RAD51 的激活剂,同时可增强 CRISPR/Cas9 的活性。
可逆的 microtubule 抑制剂。Nocodazole 抑制 Bcr-Abl,增强 CRISPR/Cas9 的活性。
一种内酯抗生素,是蛋白质运输的特定抑制剂。Brefeldin A 还是一种 CRISPR/Cas9 激动剂,可抑制 HSV-1病毒,并具有抗癌活性。
SCR7 pyrazine
一种 DNA 连接酶 IV (DNA ligase IV) 抑制剂。SCR7 pyrazine 也是一种 CRISPR/Cas9 的增强子,可提高 Cas9 介导的同源性定向修复(HDR)的效率。
SCR7
一种不稳定的形式,可以自动循环成稳定形式的 SCR7 pyrazine是一种 CRISPR/Cas9 的增强子,可提高 Cas9 介导的同源性定向修复(HDR)的效率
Zidovudine
一种核苷逆转录酶抑制剂 (NRTI),有潜力用于 HIV 感染的研究。Zidovudine 增强 CRISPR/Cas9调节的编辑频率。

 2022-03-11
2022-03-11 
 MCE小分子
MCE小分子
